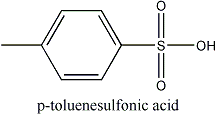
Existem vários ácidos “fortes” que são em essência completamente dissociados na água – ácido clorídrico e sulfúrico são dois exemplos. Infelizmente, são frequentemente voláteis (como o HCl), insolúveis, ou não se adaptam bem em solventes orgânicos. Os ácidos sulfônicos (orgânicos) são fortes – o grupo funcional é essencialmente ácido sulfúrico com uma das valências ocupada por um grupo funcional com carbono em vez de um -OH. O ácido para-toluenosulfônico, ou ácido tosílico é o de uso mais comum em laboratórios. Mais forte que ácidos carboxílicos (e outros ácidos orgânicos), o tosílico é muito usado como um catalisador ácido em sistemas não-aquosos.
O cloreto de tosila, este ácido clorado (onde o -OH é trocado por um -Cl) é muito usado para criar ‘tosilatos’, ou ésteres do ácido tosílico, a partir de álcoois. Estes tornam os álcoois mais reativos à substituição. O cloreto de tosila tem um odor que é uma mistura de pipoca com manteiga, fenol e borracha, nesta ordem.
http://scienceblogs.com/moleculeoftheday/2006/12/ptoluenesulfonic_acid_greasy_s.php
Original (English) content from Molecule of the Day (http://scienceblogs.com/moleculeoftheday). Content translated with permission, but portuguese text not reviewed by the original author. Please do not distribute beyond this site without permission from both author and translator.
DÚVIDA:
acido + acido = Base ???????
aguardo resposta urgente.
Obrigada,
Míriam Muniz