Sais são estruturas de espécies com carga (íons). Eles têm uma tendência em permanecerem sólidos devido a fortes interações existentes entre as espécies com carga. Cerca de cem anos atrás, as pessoas começaram a perceber que certos compostos contendo íons fundiam em temperatura próxima a ambiente. Esta é uma classe especial de líquidos – são muito polares e capazes de dissolver várias substâncias incomuns. Eles também tendem a não evaporar muito facilmente, isso por existir fortes interações entre os componentes do sal. Por essas razões, muitas pessoas sugeriram que poderiam ser usados em “química limpa”, nos quais os líquidos iônicos (LIs) seriam usados e reutilizados (com uma menor emissão de vapores em comparação com solventes comumente utilizados).
No entanto os LIs não são tão inócuos – só por terem baixa pressão de vapor não significa que não são tóxicos. Muitos realizaram várias pesquisas com essas substâncias, por serem elegantes e estarem na moda atualmente. Nem sempre o que fazem tem alguma utilidade. Alguns químicos brincam que colocando “líquidos iônicos” em um título de uma publicação é meio caminho andado para ter o artigo aceito, só perdendo em charme para o “nano”.
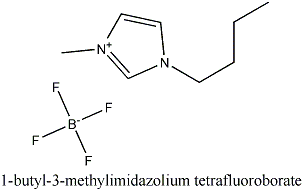
Manias à parte, os LIs podem ser interessantes. Você pode, por exemplo, dissolver madeira em um LI. O sal abaixo, tetrafluoroborato de 1-butil-3-metilimidazolio (ou BMIM), é um LI muito estudado. Este fica líquido mesmo em temperaturas abaixo do congelamento da água.
http://scienceblogs.com/moleculeoftheday/2007/01/bmim_ionic_liquid_or_molten_sa.php
Original (English) content from Molecule of the Day (http://scienceblogs.com/moleculeoftheday). Content translated with permission, but portuguese text not reviewed by the original author. Please do not distribute beyond this site without permission from both author and translator.