Certos compostos ocorrem como “hidratos”; o que significa, com uma ou mais moléculas de água. Algumas vezes existe água presa somente na estrutura cristalina em uma estequiometria específica (por exemplo na creatina), e algumas vezes a água está verdadeiramente incorporada na molécula, como no formaldeído hidrato.
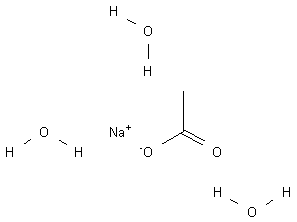
O acetado de sódio trihidratado é a primeira situação – só cristais de acetato de sódio mais 3 moléculas de água. Se você aquecer ele “funde”, mas está digamos não “fundido”, e você estaria simplesmente dissolvendo o acetato de sódio na água fazendo uma solução de aproximadamente 10M – que é bem acima do limite de saturação; mas que permanecerá em solução até não ter mais uma razão para isso. Você pode até mesmo resfriar até temperatura ambiente que a substância permanecerá líquida indefinidamente.
Se você induz a cristalização, digamos que pela introdução de um pouco de poeira na solução, terá então o retorno para a forma sólida, e uma grande quantidade de calor.
Uma ideia é colocar em um recipiente plástico que contenha um pequeno disco metálico no meio. Flexione o disco metálico e esse agirá como um sítio de nucleação que iniciará a cristalização. Faça isso e terá um prático e reutilizável aquecedor de mãos.
Original (English) content from Molecule of the Day (http://scienceblogs.com/moleculeoftheday). Content translated with permission, but portuguese text not reviewed by the original author. Please do not distribute beyond this site without permission from both author and translator.