---
---
Equação de van der Waals
A equação de van de Waals (vdW) é uma equação de estado (um modelo) para gases compostos de partículas que tem um volume diferente de zero (nota1) e forças de interação (atrativas e repulsivas). A equação foi desenvolvida por Johanner Diderik van der Waals em 1873, baseado em uma modificação da lei dos gases ideais. A equação tem uma aproximação melhor para comportamento de gases em condições que ocorrem interações entre as partículas.
Equação
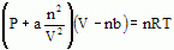 [1]
[1]
Representando em volume molar ( ![]() )
)
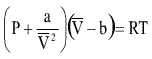 [2]
[2]
onde P é a pressão do gás, a é a medida da atração entre as partículas, V é o volume do gás, b representa o volume excluído pelas partículas, R é a constante universal dos gases e T é a temperatura (absoluta, em Kelvin). O valor de b está ligado ao raio atômico da partícula considerada, pois trata do volume excluído.
Forma reduzida da equação de van der Waals
Como a equação de van der Waals possui constantes a e b que são diferentes para cada gás, é interessante propor uma forma de representação que elimine estes fatores, tornando a equação utilizável para qualquer gás. Um modo de se conseguir isso é utilizando as variáveis reduzidas:
![]() [3]
[3] ![]() [4]
[4] ![]() [5]
[5]
nas quais, ![]() c, Tc e Pc, são volume crítico molar, temperatura crítica e pressão crítica, respectivamente, do gás considerado.
c, Tc e Pc, são volume crítico molar, temperatura crítica e pressão crítica, respectivamente, do gás considerado.
Substuindo(nota2) na equação de van der Waals obtemos (equação de van der Waals reduzida):
![]() [6]
[6]
Tendo também a possibilidade de representar o ponto crítico como:
![]() [7] ,
[7] , ![]() [8],
[8], ![]() [9]
[9]
Perceba nas equações acima [7-9] que todas estão representadas apenas pelas constantes a, b e R.
Ou ainda, isolar as constantes a, b e R. Da seguinte forma:
![]() [10],
[10], ![]() [11],
[11], ![]() [12]
[12]
Entretanto, o valor de R calculado desta forma não concorda exatamente com o valor conhecido de R. A dificuldade disto está no fato de que a vdW não é muito adequada para tratar de condições próximas ao estado crítico.
Existem outras equações para representar gases reais, que podem ser ainda melhores que a vdW.
Tabela de algumas constantes
| a (L2bar/mol2) | b (L/mol) | |
|---|---|---|
| Ácido acético | 17,82 | 0,1068 |
| Anidrido acético | 20,16 | 0,1263 |
| Acetona | 14,09 | 0,0994 |
| Acetonitrila | 17,81 | 0,1168 |
| Acetileno | 4,448 | 0,05136 |
| Amônia | 4,225 | 0,03707 |
| Argônio | 1,363 | 0,03219 |
| Benzeno | 18,24 | 0,1154 |
| Bromobenzeno | 28,94 | 0,1539 |
| Butano | 14,66 | 0,1226 |
| Dióxido de carbono | 3,640 | 0,04267 |
| Monóxido de carbono | 1,505 | 0,03985 |
| Cloro | 6,579 | 0,05622 |
| Clorobenzeno | 25,77 | 0,1453 |
| Ciclohexano | 23,11 | 0,1424 |
| Etano | 5,562 | 0,0638 |
| Etanol | 12,18 | 0,08407 |
| Hélio | 0,03457 | 0,0237 |
| Hexano | 24,71 | 0,1735 |
| Hidrogênio | 0,2476 | 0,02661 |
| Mercúrio | 8,200 | 0,01696 |
| Metano | 2,283 | 0,04278 |
| Metanol | 9,649 | 0,06702 |
| Nitrogênio | 1,408 | 0,03913 |
| Oxigênio | 1,378 | 0,03183 |
| Propano | 8,779 | 0,08445 |
| Tolueno | 24,38 | 0,1463 |
| Água | 5,536 | 0,03049 |
Fonte: Weast, R. C. (Ed.), Handbook of Chemistry and Physics (53rd Edn.), Cleveland:Chemical Rubber Co., 1972
Nota1- Na verdade não exise nenhum gás com partículas sem volume, apenas o modelo dos gases ideais assim trata.
Nota2- A matemática deste procedimento não foi desenvolvida neste texto.
Aviso: este texto é uma adaptação do material disponível na Wikipedia ( http://en.wikipedia.org/wiki/Van_der_Waals_equation ), portanto não possui direitos autorais. Não é permitida cópia para fins lucrativos. Cite as fontes Wikipedia e Glúon/FQ.
Texto criado em 20/09/2005
Revisado em ---